Lesedauer: 6 Minuten

Datei:Strontianit_und_Schwefel-1697.jpg
WISSENSWERTES Schwefelsäure gilt heute als eine der wichtigsten Chemikalien überhaupt. Aufgrund seiner Eigenschaften findet der Stoff Verwendung in zahlreichen Industriezweigen. Durch das Doppelkontaktverfahren kann er großtechnisch aus Schwefel gewonnen werden.
Die Bezeichnung Schwefelsäure (H2SO4) steht für eine stark ätzende, anorganische Säure, die im unverdünnten flüssigen Zustand farblos, ölig, viskos und hygroskopisch (wasserentziehend) ist. Sie stellt eine wichtige Grundchemikalie dar und wird zur Herstellung zahlreicher anderer Stoffe verwendet (vgl. Tabelle 1).
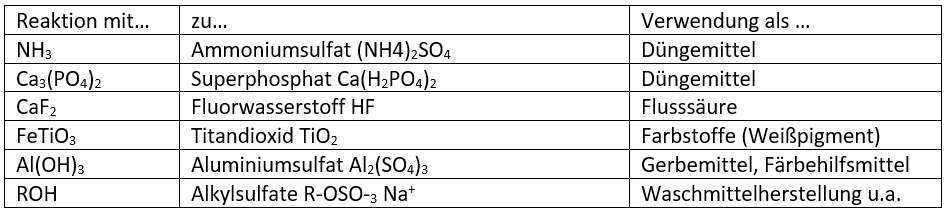
Die Hauptmenge (ca. 50 – 60% weltweit) dient zur Produktion von Düngemitteln wie Superphosphat. Ebenso ist die Säure zur Herstellung von Farbstoffen durch Erzaufschluss nötig, ein Beispiel wäre etwa das Weißpigment Titandioxid, das in mehreren Schritten aus Ilmenit (FeTi03) hergestellt wird. Weiterhin ist der Stoff zusammen mit Salpetersäure Bestandteil der Nitriersäure, welche der Produktion von Nitroverbindungen, etwa für die Sprengstoffherstellung, dient. Verdünnte Schwefelsäure wird außerdem als Elektrolyt in Bleiakkumulatoren verwendet. Konzentrierte Schwefelsäure hingegen ist aufgrund seiner hygroskopischen Eigenschaften ein sehr gutes Trockenmittel.
Gewinnung nach dem Doppelkontaktverfahren
Früher wurde die Säure nach dem Vitriolverfahren (ab 13. Jh.) und Bleikammerverfahren (ab 18. Jh.) hergestellt. Ein modernes großtechnisches Verfahren zur Gewinnung von Schwefelsäure haben die deutschen Chemiker Clemens Winkler und Rudolf Knietsch im 19. Jh. entwickelt. Dieses sog. „Kontaktverfahren“ ist allerdings bereits veraltet und durch das effizientere und umweltfreundlichere Doppelkontaktverfahren (vgl. Abb. 1) ersetzt worden. Letzteres wird heute angewandt und lässt sich grundsätzlich in drei Schritte einteilen. Es läuft nach einer kontinuierlichen Arbeitsweise ab, d.h. es werden (fast) ununterbrochen Ausgangsstoffe zugeführt und Reaktionsprodukte abgeführt.
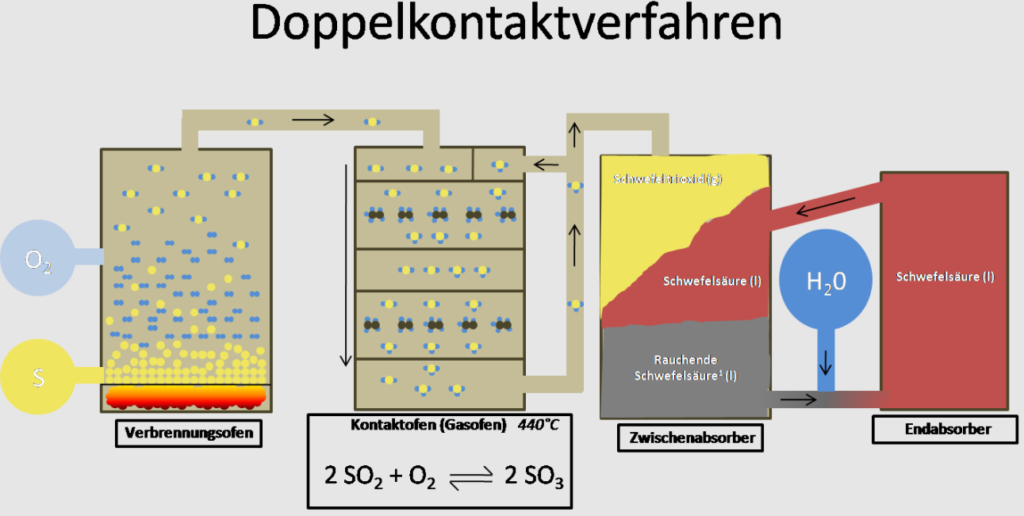
Quelle: https://commons.wikimedia.org/wiki/File:Doppelkontaktverfahren2.png
1 Verbrennungsofen
Für die technische Synthese des Stoffes wird Schwefeltrioxid benötigt. Dazu wird zunächst durch die Verbrennung von flüssigem Schwefel (geeignet ist eine Ausgangstemperatur von 135°C) mit Luftsauerstoff im Verbrennungsofen mithilfe eines Brenners Schwefeldioxid gewonnen. Die stattfindende Oxidation ist stark exotherm: S + 02 -> SO2.
2 Kontaktofen

Quelle: https://commons.wikimedia.org/wiki/File:
La_Sorbonne._M._le_professeur_H._Le_Chatelier,
_membre_de_l%27Institut.jpg
Dieses Gemisch kühlt man auf 420°C herunter, bis es dann im sogenannten Kontaktofen weiter zu Schwefeltrioxid umgewandelt (oxidiert) wird, eine ebenfalls exotherme Reaktion: 2 SO2 + O2 -> 2 SO3. Damit dies abläuft, wird das Dioxid durch mehrere Siebböden, sog. Horden, mit einer Aufschüttung des Katalysators Vanadium(V) – oxid V2O5 geleitet.
Zur idealen Ausbeute an Schwefeltrioxid müssen folgende Reaktionsbedingungen gelten:
- Temperatur: Die Reaktionstemperatur sollte bei 420 – 440°C liegen. Mit höherer Temperatur würde der Anteil an Schwefeltrioxid abnehmen (exothermes, chemisches Gleichgewicht – Prinzip von Le Chatelier), noch niedrigere Temperaturen würden jedoch die Reaktionsgeschwindigkeit verlangsamen (Arbeitstemperatur Katalysator über 400°C). Um diese Betriebstemperatur zu halten, wird die in den Horden entstehende, überschüssige Energie durch Wärmeaustauscher (nach dem Gegenstromprinzip an den kalten Ausgangsstoffen vorbei) abgeleitet.
- Druck: Die Stoffe reagieren unter Normaldruck, da die GG-Konstante bei rund 450°C einen vergleichsweise hohen und somit günstigen Wert (66 kPa-1) hat (siehe Prinzip von Le Chatelier unter einer Reaktion mit Volumenabnahme).
- Konzentrationsveränderungen: Gleichermaßen kann man den Einsatz von Sauerstoff erhöhen denn mehr Ausgangsstoffe bedeuten mehr Reaktionsprodukte. Wird ein Teil des entstehenden Schwefeltrioxids abgeleitet, werden ebenfalls mehr Reaktionsprodukte nachproduziert.
3 Absorber
Das Schwefeltrioxid wird auf ca. 70°C abgekühlt und in Absorbertürme geleitet, wo es mit konzentrierter Schwefelsäure (98%ig) zunächst zu Oleum reagiert. Diese sog. „rauchende Schwefelsäure“ ist ein Gemisch aus Schwefelsäure, gelöstem Schwefeltrioxid und Dischwefelsäure (H2S207). Unter Kühlen wird dieses Oleum dann mit einer bestimmten Menge an Wasser versetzt (Feststellung des Wasseranteils über Leitfähigkeitsmessungen), sodass Schwefelsäure entsteht: H2SO4 + SO3 -> H2S2O7 und H2S2O7 + H20 -> 2 H2SO4
Da noch nicht das ganze Schwefeldioxid im 1. Durchgang umgesetzt wird, leitet man die verbliebene Menge erneut in einen Kontaktofen, bis dann im Endabsorber mindestens 99,5%ige Schwefelsäure entsteht (deshalb der Name „Doppelkontaktverfahren“). Das Restgas wird in die Atmosphäre gegeben.
PS: Auch in die Herstellung von Kalkstickstoff und seine Bedeutung für die Stadt Wittenberg interessiert? Klicke hier.
Literaturverzeichnis
Arnold, Karin/Dietrich, Volkmar u.a., Cornelsen Verlag (Hrsg.). (2009). Chemie Oberstufe, Allgemeine Chemie, Physikalische Chemie, Berlin: Cornelsen Verlag, S. 138 ff.
Lernhelfer: Verwendung von Schwefelsäure. Zugriff am 04.07.2020
Spektrum.de: Schwefelsäure. Zugriff am 04.07.2020
Seilnacht.com: Doppelkontaktverfahren. Zugriff am 04.07.2020
Schule-Studium.de: Großtechnische Verfahren: Das Doppelkontaktverfahren zur Herstellung von Schwefelsäure. Zugriff am 04.07.2020
Fokus-Online: Schwefelsäure: Eigenschaften und Verwendung der Chemikalie. Zugriff am 04.07.2020
Chemie.de: Schwefelsäure. Zugriff am 04.07.2020
Lernhelfer: Großtechnische Herstellung von Schwefelsäure. Zugriff am 11.0.2020

